Tartalom
Az állati és emberi szövetek részletes tanulmányozásához különböző szövettani eljárások állnak rendelkezésünkre. Ahhoz, hogy a szövetek hosszan eltarthatóak és alkalmasak legyenek a mikroszkópos vizsgálatokra, a biológiai mintákat megfelelően elő kell készíteni.
A szövet eredeti szerkezetének megőrzéséhez, az enzimatikus lebontó folyamatok gátlásához különböző fixálószereket (alkoholok, aldehidek, aceton, ozmium-tetroxid) használnak. A fixálószer kiválasztásánál figyelembe kell venni, hogy az a lehető legkisebb károsodást okozza a szövetben. Mivel az alkoholok erősen zsugorító hatású vízelvonók, ma már inkább az aldehideket (paraformaldehid, glutáraldehid) alkalmazzák, melyek a fehérjék aminocsoportjai között alakítanak ki keresztkötéseket, ezáltal merevítik a szövet szerkezetét. Az ozmium-tetroxidot elsősorban az elektronmikroszkópos munkák során használják utófixálásra.
Mivel immerziós fixálás során, a fixálószer diffúzióval járja át a mintát, ügyelnünk kell a megfelelő szövetvastagságra és a fixálás optimális idejére. Perfúziós fixálás esetén a kísérleti állatot túlaltatjuk, majd a még dobogó szívbe juttatjuk a fixálóanyagot, amely a keringés révén jut el a szövetekbe.
A fixált szövet metszéséhez a mintát be kell ágyazni. Mivel a beágyazószerek nem járják át a vizes anyagokat, ezért a szövetet először egyre töményebb, felszálló alkoholsorban víztelenítjük, majd egy olyan közegbe tesszük, mely elegyedik alkohollal és a beágyazószerrel is (pl. xilol, toluol, benzol, kloroform).
Beágyazószerként gyakran használják a paraffint a fénymikroszkópos vizsgálatokhoz, mely 56 °C-on folyékony állapotú, szobahőmérsékleten szilárd, hidrofób anyag. A beágyazás során a mintát pontosan orientáljuk (erre a célra készített „csónakokban”), majd az előre megolvasztott paraffinnal kiöntjük. A blokkokat jégre tesszük, így a paraffin gyorsan megszilárdul. Ezután következhet a metszetkészítés. Az elektronmikroszkópos vizsgálatokhoz a mintákat általában műgyantába ágyazzák be.
A metszés történhet pl. mikrotómmal (szánka-mikrotóm, 5-12 µm ideális metszetvastagság): a mikrotóm késéről a metszeteket ecset segítségével meleg vízre terítjük, majd a tárgylemezekre úsztatjuk. A metszeteink ebben az állapotban paraffinnal átitatottak, víztelenek. Mivel azonban a különböző szövetfestési technikák során általában vizes bázisú festékeket alkalmazunk, elengedhetetlen a metszetek deparaffinálása (xilol) és rehidratálása (leszálló alkoholsor, végül desztillált víz).
Elektronmikroszkópos ultravékony metszetek (60-70 nm) készítéséhez ultramikrotómot használunk.
A kriosztátos (fagyasztva) metszéshez a mintákat fixálást követően cukoroldatban tartjuk, addig, amíg a cukor kitölti a víztereket. Ezután olyan médiumba ágyazzuk, mely krioprotektív anyagokat is tartalmaz, ami megakadályozza a jégkristályok képződését a szövet belsejében. Ezeket a mintákat -20°C-on kriosztátban metszük.
Kemény anyagokból, mint pl. a csont vagy a fogak, csiszolatokat készítünk.
Megint más esetekben a mikroszkópos vizsgálatokat nem metszeteken, hanem nyúzat preparátumokon (whole-mount) végezzük, melynek készítése során sztereomikroszkóp alatt csipesz segítségével akár több szövetréteget is eltávolíthatunk a mintánkról.
A metszetről vagy a preparátumról festetlen állapotban nagyon kevés információt nyerhetünk, ezért kérdéseink megválaszolására különböző festéseket végezhetünk. Vannak specifikus és nem specifikus festési eljárások is (lásd alább).
A fény- és elektronmikroszkópos technikák molekuláris biológiai vizsgálatokra is alkalmasak. Ennek példája az in situ hibridizáció, melynek segítségével adott fehérje szintéziséhez szükséges messenger RNS és kromoszómális DNS kimutatása lehetséges. Alapja a komplementer nukleinsav láncok egymáshoz való specifikus kötődése (hibridizáció). Az „in situ” pedig azt jelenti, hogy ez a hibridizációs folyamat a szöveti metszet felszínén megy végbe. Módszerek és eszközök sokasága áll tehát rendelkezésünkre, hogy választ kapjunk az általunk feltett kérdésekre, nyomon kövessük milyen változások zajlanak le egy patológiás állapot vagy egy kezelés hatására az adott szövetben.
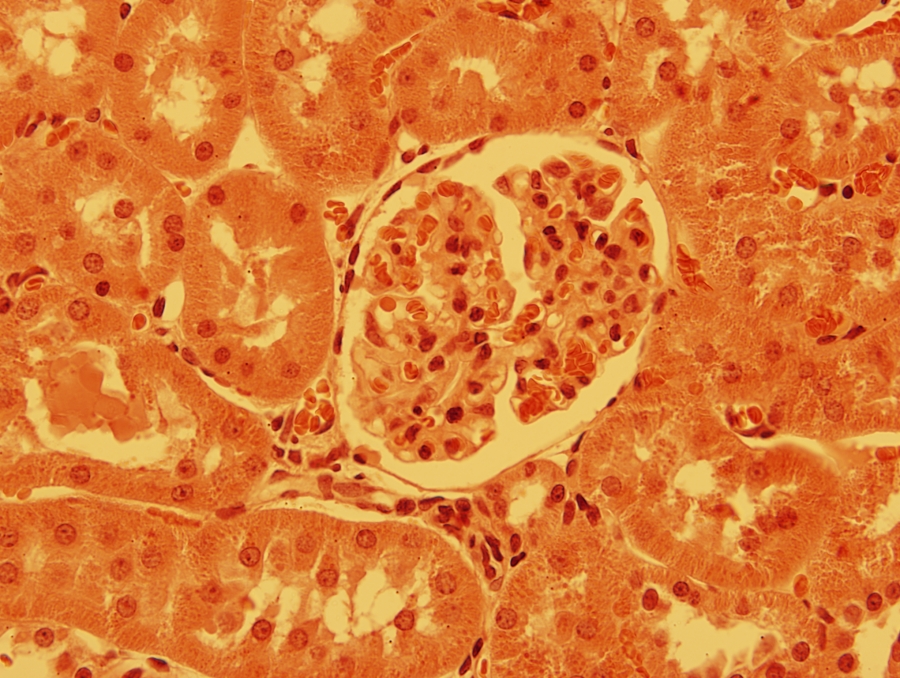
1/1. ábra Fénymikroszkópos felvétel patkány veséjéből készült metszetről hematoxilin-eozin festés után. 630x
A nem specifikus festékek többféle struktúrát megfestenek a sejtben: a bázikus festékek (hematoxilin, toluidinkék, metilénkék) a negatív töltésű molekulákhoz (nukleinsavakhoz, fehérjék karboxil-csoportjához) kötődnek, így liláskék színűre festik a sejtmagot, riboszómákat, endoplazmatikus retikulumot. A savas festékek (eozin, fukszin, orange C) jól kötődnek a fehérjék pozitív töltésű végéhez, rózsaszín vagy vöröses színűre festik a citoplazmát, a mitokondriumokat és a kollagén rostokat. A neutrális festékek (szudánvörös, szudánfekete) nem hordoznak kifejezett töltéseket, a hidrofób komponensek festésére alkalmasak (pl. lipidek). Ezeket a festékeket gyakran kombinálva alkalmazzák, az egyik leggyakoribb a hematoxilin-eozin festés. A festést követően a metszeteket fedőanyaggal (állandó: kanadabalzsam, DePeX vagy ideiglenes: glicerin) és fedőlemezzel lefedve vizsgáljuk.
Szintén a hagyományos szövettani festések közé tartozik a perjódsav-Schiff-reakció (PAS-reakció), ami a makromolekuláris glikoproteinek szénhidrát komponenseket festi püspöklila színűre.
A Camillo Golgi által először alkalmazott, az Ag+ redukálásán alapuló ezüstimpregnáció során barnásfekete csapadék képződik az idegsejtben, így kirajzólódik a neuronok sejttestje és nyúlványredszere is.
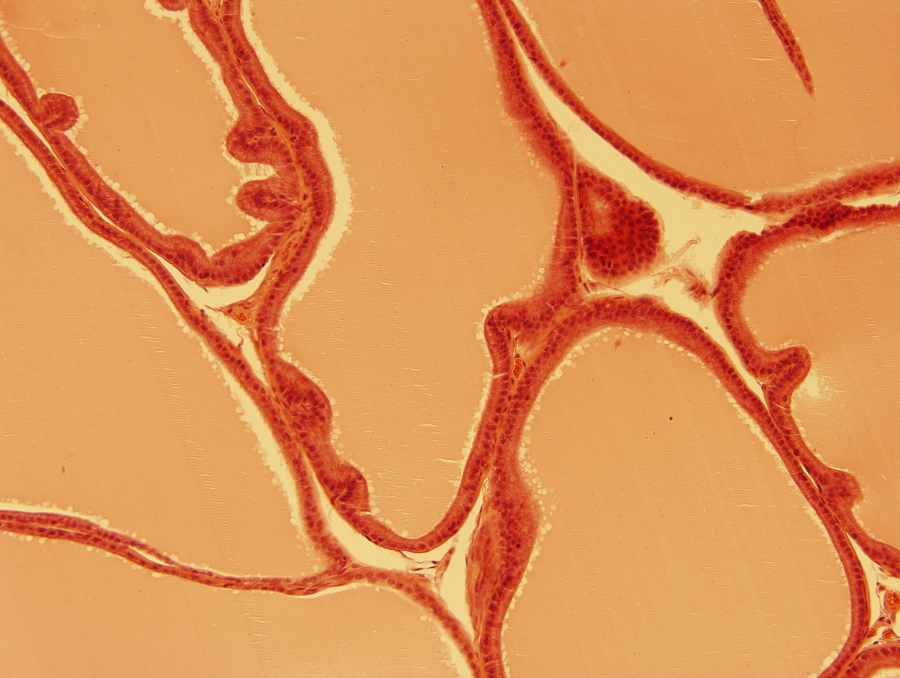
1/2. ábra Fénymikroszkópos felvétel patkány pajzsmirigyéből készült metszetről hematoxilin-eozin festés után. 200x
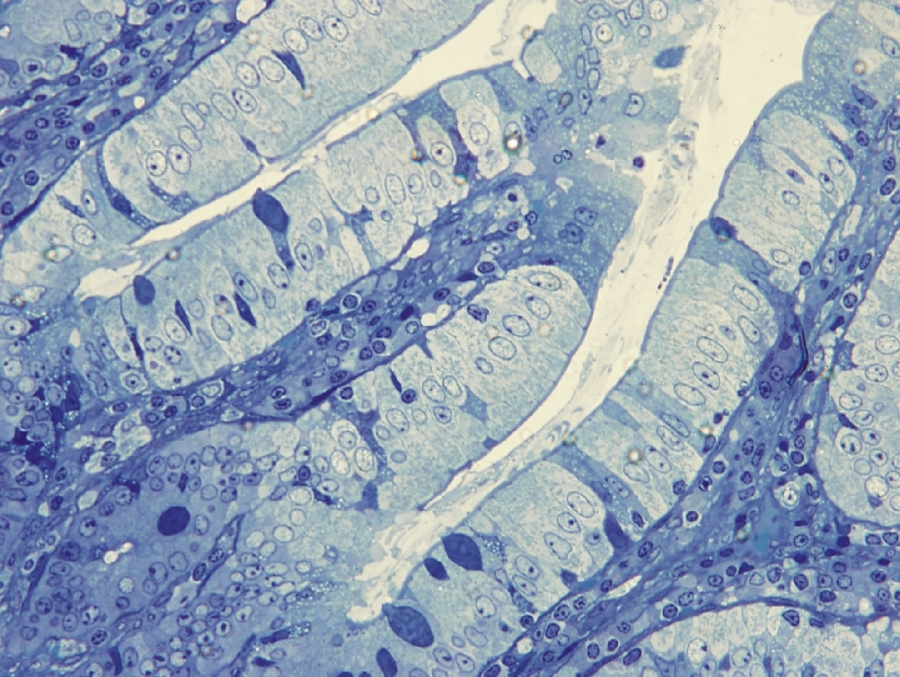
1/3. ábra Fénymikroszkópos felvétel patkány vékonybeléből készült metszetről toluidinkék festés után. 600x

1/4. ábra Fénymikroszkópos felvétel ezüstimpregnált, humán nagyagykéregből készült metszetről. 200x
Az enzimhisztokémia (pl. NADPH-diaforáz, NADH-diaforáz, kolin-észteráz) a specifikus festési eljárások közé tartozik. Jellegét tekintve indirekt technika, hiszen nem magát az enzimfehérjét mutatjuk ki vele, hanem annak aktivitásából következtetünk a jelenlétére. A módszer alapja az, hogy az enzimreakció termékét a keletkezés helyén oldhatatlan, stabil és mikroszkópban jól látható csapadékká alakítsuk. Az enzim működéséhez megfelelő körülményeket kell biztosítanunk (szubsztrát, pH, ionok, koenzimek, hőmérséklet).
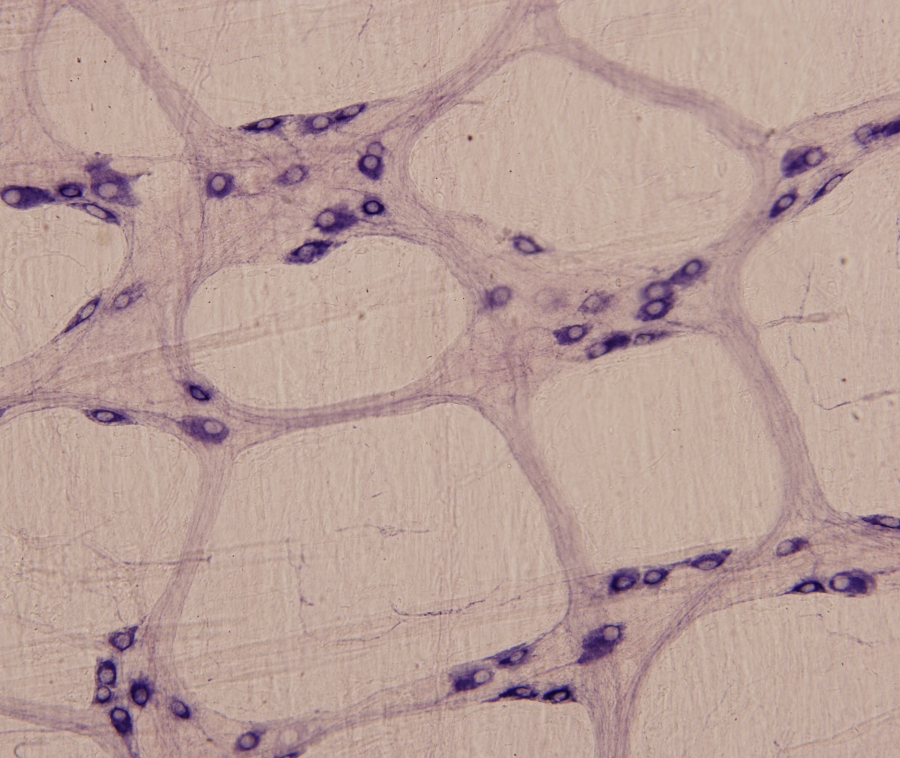
1/5. ábra Fénymikroszkópos felvétel patkány vastagbeléből készített whole-mount preparátumról. A preparátumon a bélidegrenszer entericus neuronjai láthatók NADPH-diaforáz enzimhisztokémiai festés után. 400x
Az immunhisztokémiai festések a szövettani technikák közül a legspecifikusabb jelölést teszik lehetővé. A módszer jelentősége, hogy egy konkrét fehérjemolekula vagy annak valamely epitopja lokalizálható a struktúrán belül. Alapját az antigén–antitestkötődés jelenti, ahol az antitesthez fény– vagy elektronmikroszkópban jól látható anyagot kapcsolunk.
A kimutatni kívánt fehérje (antigén) ellen egy adott állatfaj szervezetében, antitestet (ellenanyag) termeltetünk, majd azt kinyerjük. Ehhez az antitesthez különböző jelölőmolekulákat köthetünk (pl. fluoreszcens festékmolekula, radioaktív izotóp, kolloidális aranyszemcse, torma-peroxidáz), mely azután lehetővé teszi majd a nyomon követést. Immunhisztokémiai festés során a szövettani preparátumot ezzel a jelzett antitesttel inkubáljuk. Az ellenanyag specifikusan kötődik az antigénjéhez, mely ellen termeltetve lett, és így pontosan lokalizálja a keresett fehérjemolekula helyét. Az immunreakció helyét eredményét színes enzimreakcióval tesszük láthatóvá, leggyakrabban peroxidáz-reakciót vagy fluoreszcens festékeket alkalmazunk. A peroxidáz enzim diamino-benzidin (DAB) kromogén és hidrogén-peroxid jelenlétében barna, oldhatatlan csapadékot képez. A fluoreszcens festékek pedig fluoreszcens mikroszkópban különböző színben fluoreszkálnak.
Korábban az ún. direkt jelölést használták, az antigén ellen termeltetett primer antitesthez kapcsolták a jelmolekulát. Mára már sokkal elterjedtebbé vált az ún. indirekt jelölés, ahol a primer antitest ellen újabb, rá specifikus antitestet termeltetnek (szekunder antitest), és ehhez kapcsolják a jelölőmolekulát. Ez a módszer egyben felerősíti a jelölődést, érzékenysége megnő, így rendkívül kis kis mennyiségben jelenlevő fehérje kimutatására is alkalmas.
A módszerek kombinálásával lehetőségünk van kettő vagy akár több anyag együttes kimutatására is. Ebben az esetben fontos, hogy a primer antitestek különböző gazdaszervezetből származzanak, s a fajspecifikusan kötődő másodlagos antitestek pedig különböző (színű) jelmolekulát hordozzanak.
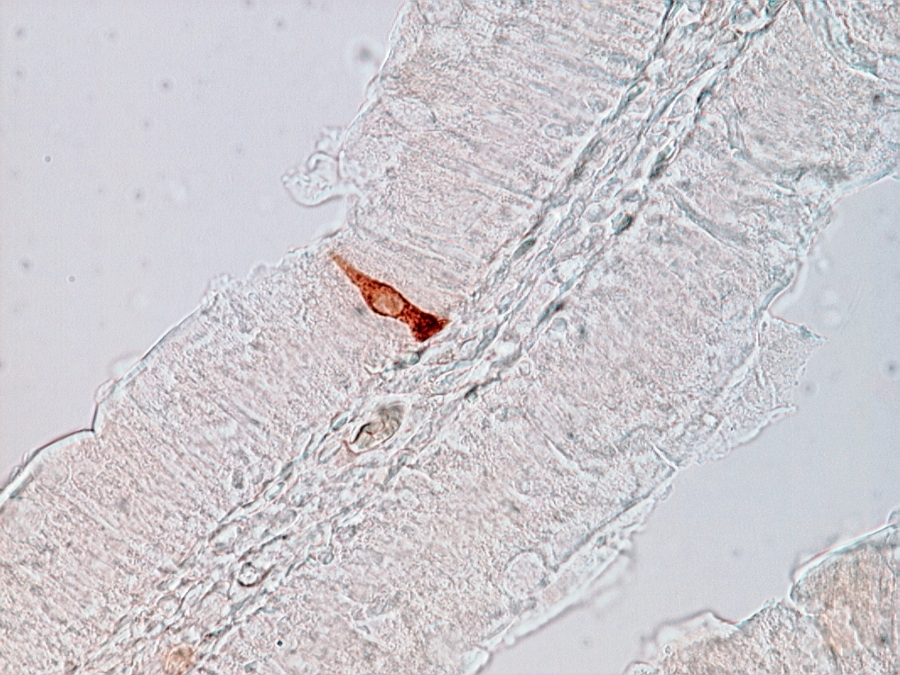
1/6. ábra Fénymikroszkópos felvétel patkány vékonybeléből készített metszetről szerotonin-immunhisztokémai festés után. A szerotonin tartalmú enteroendokrin sejtet a DAB barnán jelöli. 400x